principio de le chatelier explicación , eneuciado ejemplos , Ejercicios y problemas resueltos , con solución en vídeo , paso a paso , desde cero Tema de equilibrio químico , química 2 bachillerato , bachiller y universidad , selectividad ,PAU EBAU EVAU , PDF
esta entrada pertence al curso para ser unas máquinas de equilibrio químico
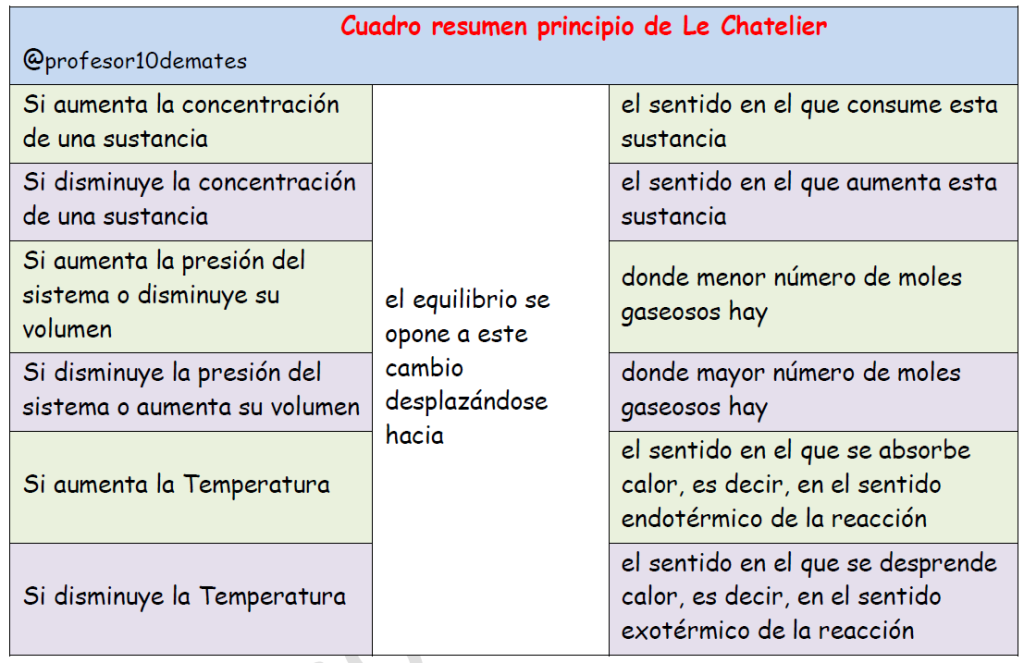
Principio de Le Chatelier esquema resumen
El Principio de Le Chatelier establece que si una reacción en equilibrio es perturbada desde el exterior, el sistema evoluciona en el sentido de oponerse a los efectos de dicha perturbación.
problema con solución explicado en vídeo
Selectividad PAU química Castilla y León Junio 2012 5B
5 B El tricloruro de fósforo reacciona con cloro para dar pentacloruro de fósforo según la
siguiente reacción: PCl3 (g) + Cl2 (g) ⇆PCl5 (g) DHo = – 88 kJ · mol–1.
Una vez alcanzado el equilibrio químico, explica cómo se modificará el mismo si:
- a) Se aumenta la temperatura.
- b) Se disminuye la presión total.
- c) Se añade gas cloro.
- d) Se introduce un catalizador adecuado.
Solución:ver explicación
a) Por el principio de Le Chatelier al elevar la temperatura el equilibrio evoluciona en el sentido en el que se produce absorción de calor, es decir, en el sentido endotérmico de la reacción. Por tratarse de una reacción exotérmica, un aumento de la temperatura provoca un desplazamiento del equilibrio hacia la izquierda.
b) Una disminución de la presión ,por el principio de Le Chatelier , el equilibrio se desplazará hacia donde hay mayor número de moles gaseosos , para oponerse a este cambio . En este caso hacia la izquierda.
c) La introducción del reactivo Cl2 aumenta su concentración, por el principio de Le Chatelier el equilibrio tenderá a oponerse a este cambio desplazándose hacia la derecha.
d) La introducción de un catalizador no provoca desplazamiento alguno en el equilibrio de la reacción . El catalizador aumenta la velocidad de la reacción , disminuyendo la energía de activación
Ejercicios resueltos en el que tenemos que aplicar el prinicipo de Le Chatelier Selectividad química 2022
Para el siguiente proceso a 686ºC : CO2(g) + H2(g) ⇆ CO(g)+H2O(g) las concentraciones en equilibrio de las sustancias reaccionantes son : [CO2]= 0,086M [H2]=0,045M [CO]=0,50M [H2O]=0,04M
a) Calcula Kc y Kp
b) Si la concentración de CO2 se eleva hasta 0.5M por adición de CO2 , ¿Cuales serían las concentraciones de todos los gases cuando se restableciera el equilibrio?
PRINCIPIO DE LE CHATELIER EXPLICADO CON UNA LATA DE COCA COLA
Reacción química
El ácido carbónico se descompone en agua y dióxido de carbono
H2CO3 (aq) → H20 (l) + CO2 (g) ∆H>0
Al abrir la lata de cocacola , disminuiremos la presión y aumentaremos el volumen , por el principio de Le chatelier , al disminuir la presión , para contrarestar este cambio el equilibrio se desplazará hacia donde mayor número de moles gaseosos hay , en este caso hacia la izquierda , es decir hacia la producción de CO2
Como el CO2 se escapa por la boquilla de la lata , disminuirá la concentración de CO2 , por el principio de Le chatelier , el equilibrio contrarrestará esta variación desplazándose hacia la formación de CO2 ( hacia la derecha)
En verano al aumentar la temperatura por el principio de Le chatelier , el equilibrio evoluciona en el sentido en el que se produce absorción de calor, es decir, en el sentido endotérmico de la reacción. Por tratarse de una reacción endotérmica el equilibrio se desplazará hacia la derecha , es por esto que las bebidas gaseosas en verano pierden más rápido el gas.
esta entrada pertence al curso para ser unas máquinas de equilibrio químico
PDF libro vídeo EQUILIBRIO QUÍMICO en BUBOK









3 comentarios
Ahh gracias, pude entender como se relacionaba lo de que en una reacción exotérmica con el primer punto. 😀
Excelente ejemplo Profe!!!
Gracias