Equilibrio químico fórmulas de las constantes y sus relaciones explicación , ejemplos y ejercicios resueltos química 2º bachillerato , bachiller y pruebas de acceso , selectividad PAU Universidad problemas con solución paso a paso , desde cero
1 Constante de equilibrio Kc
Siendo [ ] la concentración Molar de cada una de las sustancias en equilibrio
En Kc solo entran en juego los gases y las disoluciones acuosas
Kc es una constante que solo depende de la temperatura
2 Constante de equilibrio Kp
Siendo PA las presiones parciales de cada una de las sustancias en equilibrio
En Kp solo entran en juego los gases
Kp es una constante que solo depende de la temperatura
Para el cálculo de las presiones parciales en el equilibrio tenemos 2 métodos
3 Relación entre Kp y Kc
Kp = Kc(RT)Dn
Siendo Dn= número de moles gaseosos de los productos menos el número de moles gaseosos de los reactivos (mirando los coeficientes estequiométricos)
4 IMPORTANTE trucos y consejos profesor10demates
- a) Si me dan el volumen primero calculo Kc
- b) Si me dan la presión primero calculo Kp
- c) Si me dan el volumen la presión total y la temperatura primero haremos PTV=nTRT y luego calculamos la constante que prefiramos
- d) Si Dn=0 ocurren 2 cosas
d.1) El volumen no influye en el cálculo de Kc
d.2) Kc=Kp
SUPER FORMULARIO EQUILIBRIO QUÍMICO
proyecto , puedes hacerlo fácilmente con el botón de compartir de Facebook , twitter y de las demás
redes sociales .Os aconsejo que me sigáis en Facebook o en Twitter ,
y también en Youtube , así
estaréis mejor informados de las novedades

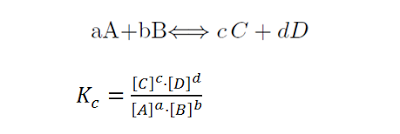
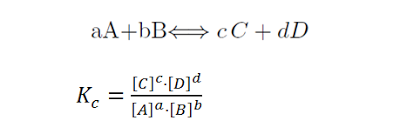
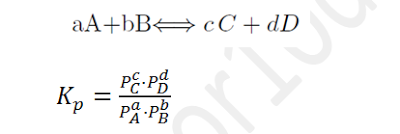








Un comentario
excelentes tutoriales!!!