Aprenderemos y justificaremos cómo varían las PROPIEDADES PERIÓDICAS de los elementos ( Radio atómico , iónico , afinidad electrónica , energía de ionización , electronegatividad y el caracter metálico ) dentro de la Tabla periódica . 2º BACHILLERATO Y UNIVERSIDAD Ejercicios resueltos paso a paso
PROPIEDADES PERIÓDICAS
¿Cómo varía el valor de las propiedades periódicas?
Lo primero que vamos a hacer es un mapa conceptual , resumen o esquema , para aprender la variación de las propiedades periódicas en la tabla ver vídeo explicativo
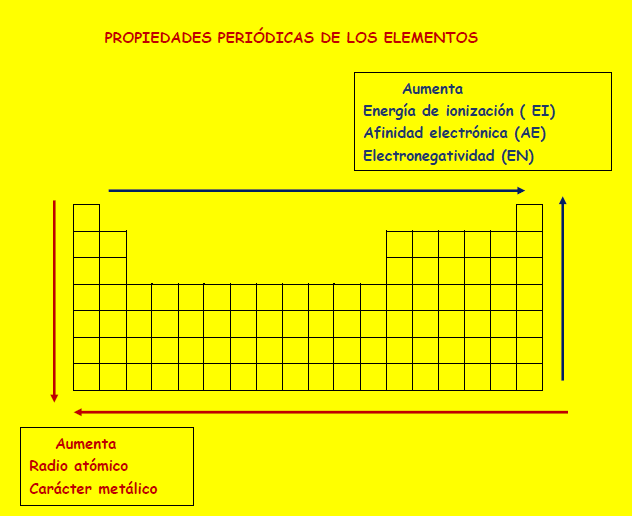
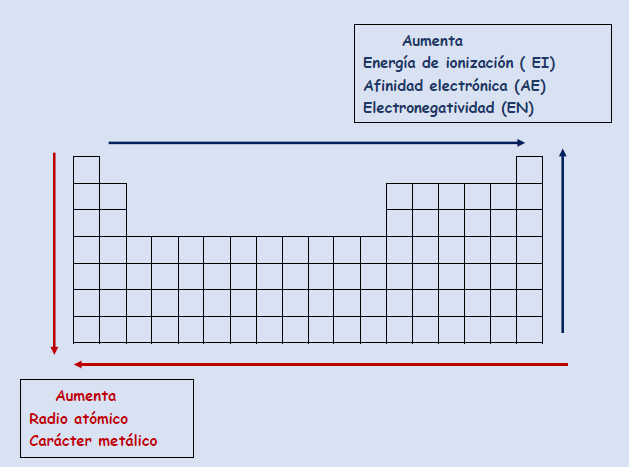
El radio atómico y el carácter metálico dentro de un mismo grupo aumentan hacia abajo y dentro de un mismo periodo de derecha a izquierda
La energía de ionización , la afinidad electrónica y la electronegatividad , dentro de un mismo grupo aumenta hacia arriba y dentro de un mismo periodo de derecha a izquierda
Una vez visto el esquema vamos a hacer un ejemplo para entenderlo mejor
Ejemplo resuelto Ver solución
Ordena de mayor a menor radio y afinidad electrónica el Sodio , el litio y el nitrógeno
Una vez que ya hemos hecho un resumen de cómo varian las propiedades periódicas , ahora vamos a hacer un súper resumen para justificarlo y explicarlo bien en los exámenes , es importante que lo entiendas , así conseguiremos la máxima puntuación en el examen , ( una mala explicación suele bajar mucho la nota en los exámenes ) y además resolveremos varios ejemplos , para que veas cómo hay que expresarse en los exámenes .
Para una bueba explicación tendremos que entender primero que es el apantallamiento y la carga nuclar efectiva asi que Vamos a por ello !
Apantallamiento y carga nuclear efectiva
Apantallamiento
Es debido a la repulsión entre los electrones del átomo y disminuye la fuerza de atracción del núcleo ver vídeo explicativo
Carga nuclear efectiva
Debido al apantallamiento , los electrones del último nivel recibirán una menor atracción que llamaremos atracción efectiva.
La carga nuclear efectiva Z* , será entonces la carga que debería tener el núcleo para que en ausencia de otros electrones , ese electrón tuviese esa fuerza de atracción efectiva .
Fórmula Z*=Z-a
Siendo Z el número atómico ( número de protones)
a el apantallamiento
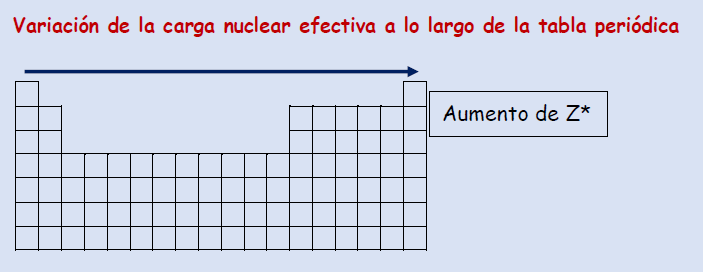
Variación de la carga nuclear efectiva a lo largo de la tabla periódica
Periodo Dentro de un mismo periodo la carga nuclear efectiva Z* aumenta de izquierda a derecha ya que aumenta el número atómico pero el apantallamiento no
Grupo Dentro de un mismo grupo la carga nuclear efectiva Z* no varía ya que el número atómico y el apantallamiento aumentan en la misma forma
Cómo calcular el apantallamiento
Hay dos tipos de apantallamiento , el de los electrones de los niveles internos ( o del Kernel ) y el apantallamiento de los electrones del mismo nivel energético
Los electrones de los niveles internos ( kernel ) producen un apantallamiento máximo donde tomaremos como a= 1 para cada electrón del kernel
Los electrones del nivel de valencia aportarán un apantallamiento menor tomaremos a<1 para cada electrón del mismo nivel energético
Veamos un ejemplo VER SOLUCIÓN
Calcula el apantallamiento para el último electrón del Berilio ( Z= 4) y del Silicio ( Z= 14)
Solución
- a) Apantallamiento del Berilio
Hacemos la configuración electrónica del Berilio
Be( Z=4) → 1s2 2s2
Tenemos dos electrones del kernel 1s2 , como a los electrones del kernel le damos valor a=1 luego nos darán un valor de apantallamiento 2
Solo hay un electrón en el mismo nivel que el ultimo 2s1 a esos electrones le damos un valor a<1
Luego el apantallamiento total será
2·1+ 1·(a´<1)
Luego el valor del apantallamiento para el Berilio estará entre 2 y 3 → 2<a<3
- b) a) Apantallamiento del Silicio
Hacemos la configuración electrónica del Silicio
Si( Z=14) → 1s2 2s2 2p6 3s2 3p2
Tenemos 10 electrones del kernel 1s2 2s2 2p6 , como a los electrones del kernel le damos valor a=1 luego nos darán un valor de apantallamiento 10
Tenemos 3 electrones en el mismo nivel que el ultimo 3s2 3p1 a esos electrones le damos un valor a<1
Luego el apantallamiento total será
10·1+ 3·(a´<1)
Luego el valor del apantallamiento del Silicio será mayor de 10→ a>10
Como calcular la carga nuclear efectiva.
Ejemplo resuelto ver solución
Calcula la carga nuclear efectiva sobre el electrón más externo de Na(Z= 11) y Al ( Z= 13)
- a) carga nuclear efectiva del Na
Hacemos la configuración electrónica del Na
Na( Z=11) → 1s2 2s2 2p6 3s1
Apantallamiento
Tenemos 10 electrones del kernel 1s2 2s2 2p6 , como a los electrones del kernel le damos valor a=1 luego nos darán un valor de apantallamiento 10
No hay un electrones en el mismo nivel
Luego la carga nuclear efectiva será
Z*=Z-a= 11-10=1
- b) carga nuclear efectiva del Al
Hacemos la configuración electrónica del Al
Al( Z=13) → 1s2 2s2 2p6 3s2 3p1
Apantallamiento
Tenemos 10 electrones del kernel 1s2 2s2 2p6 , como a los electrones del kernel le damos valor a=1 luego nos darán un valor de apantallamiento 10
Tenemos 2 electrones en el mismo nivel que el ultimo 3s2 a esos electrones le damos un valor a<1
Luego la carga nuclear efectiva será
Z*=Z-a= 13-(10+2·a<1)=13-10-2·a<1= 3-2·a<1 , luego la carga nuclear efectiva del aluminio será menor que tres Z*<3
Una vez que dominamos el apantallamiento y la carga nuclear efectiva , ya podemos entender perfectamente las propiedades periódicas ( radio atómico , iónico , afinidad electrónica , energía de Ionización , electronegatividad y caracter metálico )
TE DEJO LOS ENLACES !!!!!!!!!!!!!!!!!!!!
RADIO IÓNICO [ y sustancias isoelectrónicas]
otras entradas que te pueden interesar
CURSO MATEMÁTICAS 2 BACHILLERATO
UNIVERSIDAD MATEMÁTICAS FÍSICA Y QUÍMICA