Modelo atómico de Rutherford caractererísticas principales , explicación , esquema resumen experimento de Rutherford de la lámina de oro
Esta entrada pertenece al Tema Modelos atómicos
Modelo Atómico de Rutherford
Experimento de Rutherford
En 1911 bombardeó con partículas alfa ( que están cargadas positivamente) una delgada lámina de oro , y observó los choques de las partículas que la atravesaban sobre una pantalla situada detrás de la lámina.
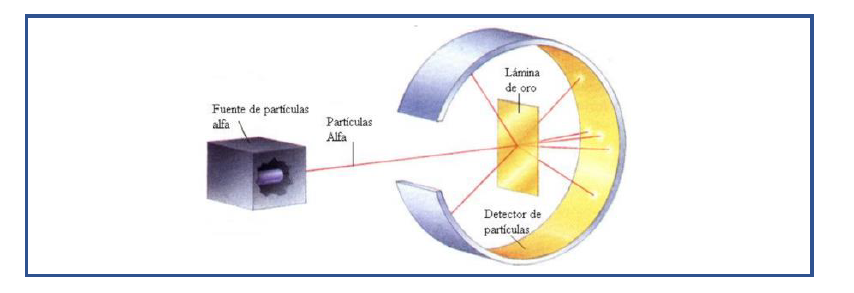
Rutherford esperaba que siguiendo el modelo atómico de Thomson , las partículas no se desviasen , ya que los átomos tendrían carga uniformemente distribuida.

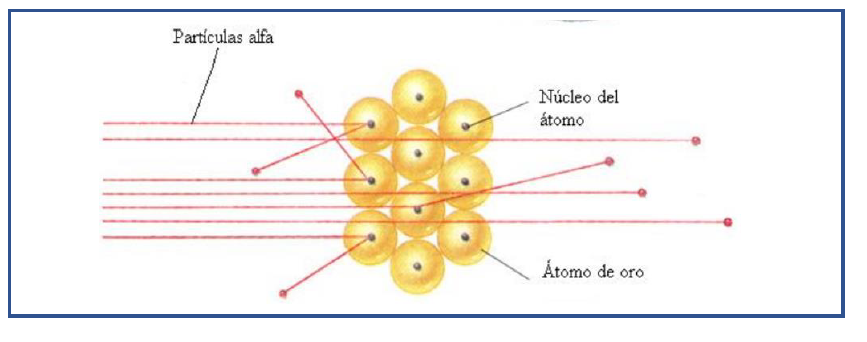
Observó que esto era lo que ocurría en la mayoría de los casos , pero algunas partículas alfa se desviaban de su trayectoria y lo más importante algunas rebotaban hacia atrás (aprox 1 de cada 20.000 ), la deducción de Rutherford fue que esto solo era posible si las partículas alfa se encontraban con corpúsculos positivos y de gran densidad
Gracias a estos resultados propuso un nuevo modelo atómico
Modelo atómico de Rutherford
Conclusiones experimento de Rutherford
La materia está prácticamente “hueca “ , ya que la mayor parte de las partículas alfa la atraviesan sin desviarse
Las partículas alfa se desvían al pasar cerca de las partículas positivas , y revotan cuando “ chocan “ como esto ocurre raramente , estas partículas ocupan un espacio muy pequeño que denominaremos núcleo.
En el núcleo se encuentra toda la carga positiva y casi toda la masa del átomo
Deben existir cargas neutras en el núcleo para que sea estable
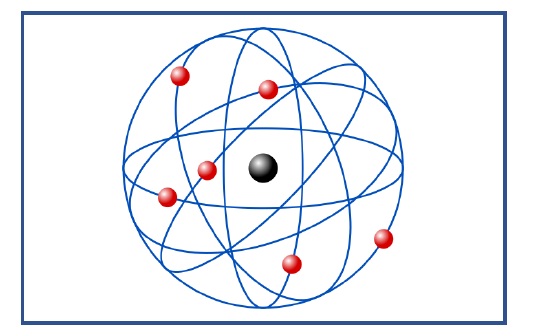
Los electrones deben girar alrededor del núcleo
A este modelo se le llama comúnmente , como “modelo planetario“
Resumen Modelo Atómico de Rutherford Características principales
- Toda la carga positiva y la mayor parte de la masa del átomo se encuentran en una zona minúscula central denominada núcleo. La mayor parte del átomo está vacía.
- La magnitud de la carga positiva de cada átomo es diferente para cada elemento, y aproximadamente la mitad de la masa atómica del elemento
- En la corteza, los electrones , giran en orbital circulares alrededor del núcleo , siendo el número de electrones igual al de las cargas positivas. De esta forma el elemento es neutro.
Esta entrada pertenece al Tema Modelos atómicos
OTRAS ENTRADAS QUE TE PUEDEN INTERESAR
CURSO DE FÍSICA Y QUÍMICA 3º ESO
CURSO DE MATEMÁTICAS 1º BACHILLERATO
CURSO DE MATEMÁTICAS SOCIALES 1º BACHILLERATO
CURSO DE FÍSICA Y QUÍMICA 1º BACHILLERATO








