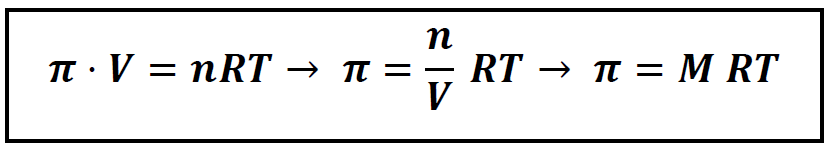Curso de propiedades coligativas de las disoluciones desde cero con ejemplos ejercicios y problemas con solución paso a paso . Física y química 1º bachillerato Universidad . Disminución presión de vapor . Disminución punto fusión . Aumento del punto de ebullición y presión osmótica
ÍNDICE:
- Definción propiedades coligativas
- Súper formulario Resumen propiedades coligativas
- Definición presión de vapor
- Definición Presión osmótica
- Ejercicios propiedades coligativas de las disoluciones resueltos
SÚPER RESUMEN FORMULARIO PROPIEDADES COLIGATIVAS DE LAS DISOLUCIONES
Propiedades Coligativas
Son aquellas cuyo valor depende solamente de la concentración del soluto, no de su naturaleza
Fórmula Disminución de la presión de vapor ∆p
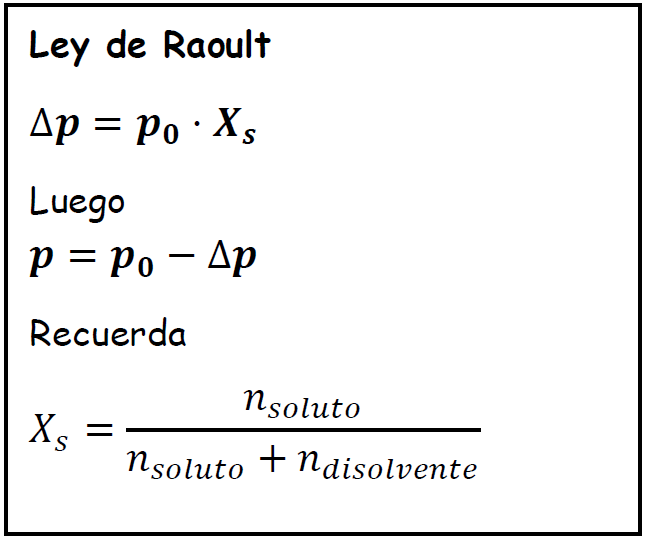
p0 Presión de vapor del disolvente
p Presión de vapor de la disolución
Clave : Las presiones tienen que tener todas las mismas unidades
Xs Fracción molar del soluto (adimensional)
Nota: La ley de Raoult se cumple para cuando a un disolvente volátil le añadimos un soluto no volátil que no produzca iones
Fórmulas Aumento del punto de ebullición ∆Te , Ascenso ebulloscópico

Ke Constante ebulloscópica ( ºC·kg/mol)
m molalidad (Importante)
Te Temperatura de ebullición del disolvente puro
T Temperatura de ebullición de la disolución
Clave : Podemos trabajar con las temperaturas en ºC
FÓRMULAS Disminución del punto de congelación ∆Tc , Disminución crioscópica

Kc Constante crioscópica ( ºC·kg/mol)
m molalidad (Importante)
Tc Temperatura de congelación del disolvente puro
T Temperatura de congelación de la disolución
Clave : Podemos trabajar con las temperaturas en ºC
FÓRMULAS Presión Osmótica
VER EXPLICACIÓN FÓRMULA PRESIÓN OSMÓTICA
π presión osmótica en atmósferas
V volumen en litros
n número de moles
R=0,082 atm·L/mol·k
T temperatura en Kelvin
M concentración molar o molaridad
Recuerda 1atm=760mmHg
EXPLICACIÓN Teoría Disminución de la presión de vapor
Definición presión de vapor
Ver explicación presión de vapor
La presión de vapor de un líquido es la presión a la que este líquido se encuentra en equilibrio con su fase gaseosa (el número de partículas que pasan a fase gaseosa es el mismo que el número de partículas que pasan a fase líquida) La presión de vapor depende de la Temperatura

El soluto dificulta el paso de las moléculas de líquido a su fase gaseosa, por la tanto disminuye la presión de vapor
Teoría presión osmótica
Ver explicación presión osmótica
En la ósmosis las moléculas de disolvente pasan a través de una membrana semipermeable desde el disolvente puro hasta la disolución . La presión necesaria para impedir el proceso de ósmosis , es la presión osmótica.
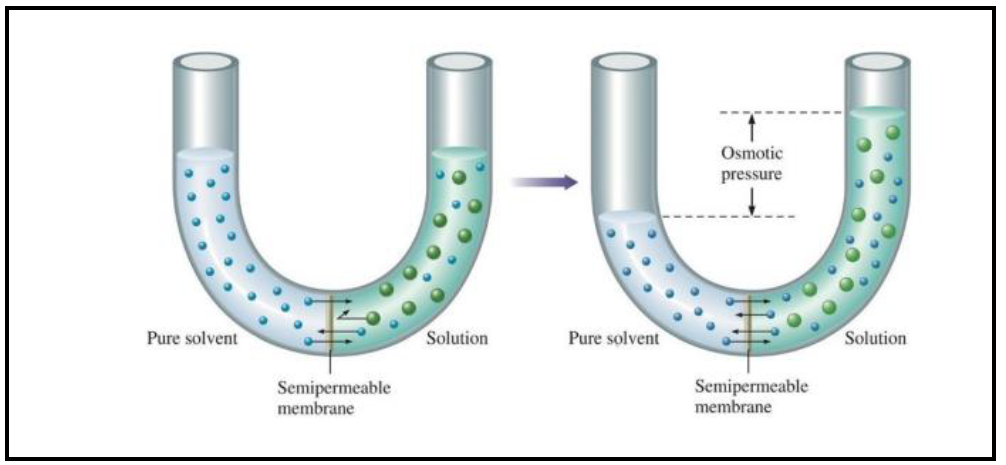
Nota: Se usa mucho para calcular masas moleculares de sustancias por eso es un ejercicio clásico de examen que veremos más adelante en la lista de reproducción del tema
Ejercicios resueltos propiedades coligativas de las disoluciones
Disminución de la presión de vapor Ejercicios resueltos
Ejercicio resuelto 1
Calcula la presión de vapor que tiene una disolución que a 25 °C contiene 23 g de glicerina C3H8O3 , en 90 g de agua, sabiendo que la presión de vapor del agua pura a esa temperatura vale 23,8 mmHg
Ejercicio resuelto 2 Clásico de examen
Al disolver 20 g de una sal en 200 g de agua la presión de vapor pasa de
50 mmHg a 47’8 mmHg. Hallar la masa molecular de la sal.
Ascenso del punto de ebullición Ascenso ebulloscópico
Ejercicios resuelto
Calcula la temperatura de ebullición de una disolución que se obtuvo disolviendo 20 g de glucosa, C6H10O5 , en 250 g de agua.
Datos: C=12;H=1;O=16 ;Ke=0,52 ºC·kg/mol
Disminución del punto de congelación ∆Tc , Disminución crioscópica
Ejercicios resueltos
Calcule el punto de congelación de una disolución formada por 100 g de anticongelante etilenglicol (C2H6O2) en 900 g de agua
Datos: C=12;H=1;O=16 ; Kc=1,86 ºC·kg/m.
Presión Osmótica Ejercicios resueltos
Ejercicios resueltos 01
Calcula la presión osmótica de una disolución que contiene 12 g de sacarosa (C12H22O11) en 500 ml de disolución, a 20 ºC.
Datos : C=12;H=1;O=16
Ejercicios resueltos 02 Clásico de examen
Una disolución de 4,00 g de hemoglobina en 200 ml de disolución tiene una presión osmótica igual a 0,0078 atm, a 20º C. ¿Cuál es la masa molecular de la hemoglobina?
OTRAS ENTRADAS QUE TE PUEDEN INTERESAR
CURSO DE FÍSICA Y QUÍMICA 3º ESO
CURSO DE MATEMÁTICAS 1º BACHILLERATO
MATEMÁTICAS SOCIALES 1º BACHILLERATO
CURSO DE FÍSICA Y QUÍMICA 1º BACHILLERATO
CURSO MATEMÁTICAS 2 BACHILLERATO
UNIVERSIDAD MATEMÁTICAS FÍSICA Y QUÍMICA