PROBLEMAS Y EJERCICIOS DE DISOLUCIONES Nivel 2
Ahora vamos a subir el nivel de dificultad de los ejercicios, también vamos a utilizar las fórmulas de molalidad y fracción molar , que aún no, las hemos usado.
La mayoría de los ejercicios son de selectividad. Ver explicación de fórmulas
gramos de soluto + gramos de disolvente = gramos de disolución
Problema 16
Calcular la molalidad de un ácido clorhídrico comercial del 35% en masa y densidad 1,18 g/mL.
Datos: A(Cl)=35,5; A(H)=1 ver solución
Problema 17
Calcula la fracción molar de un ácido sulfúrico comercial del 95% en masa y densidad de 1,83 g/cm3
Datos : Masas atómicas H=1 ; O=16 ;S =32 ver solución
SÚPER FORMULARIO Y RESUMEN DE DISOLUCIONES
Clásico de examen
Calcula la Molaridad, molalidad y fracción molar de un ácido clorhídrico comercial del 30% en masa y densidad 1,2 g/mL.ver solución
Problema 18
Calcula la Molaridad , molalidad y fracción molar de un ácido nítrico comercial del 30% en masa y densidad de 1,41g/cm3
Datos: A(H)=1;A(N)=14; A(O)=16; ver parte1 ver parte 2
Problema 19
Selectividad química Castilla y León Junio 2010 5 AEn una botella de ácido clorhídrico concentrado figuran los siguientes datos: 36 % en
masa de HCl, densidad 1,18 g/mL. Calcula:
- a) La molaridad, molalidad y fracción molar del ácido.
- b) El volumen de este ácido que se necesita para preparar 1 L de disolución 2 M.
Ver parte 1 parte 2 parte 3 parte 4
Problema 20
Selectividad química Castilla y León Septiembre 2009 5 AUna disolución de hidróxido de potasio contiene 22,4 g de la base en 400 cm3
de disolución. Se toman 100 cm3 de dicha disolución, cuya densidad es 1,01 g · cm–3 a los que se añaden 200 cm3de otra disolución 1,2 M de la misma sustancia, y 10cm3 de agua.
a) ¿Cuál será la molalidad, fracción molar y tanto por ciento en peso de la disolución inicial de KOH?
b) ¿Cuántos gramos de soluto habrá en 20 cm3 de la nueva disolución, suponiendo que los volúmenes son aditivos?
DATOS: Ar(K) = 39,10 u; Ar(O) = 16,0 u; Ar(H) = 1,008 u.
Resultado: a) 1,048 molal; χ (KOH) = 0,0185; [KOH] = 5,54 %; b) 0,954 g KOH.
Problema 21
Selectividad química Castilla y León Junio 2009 5 A
Se quiere preparar una disolución de H2SO4 del 20 % y densidad 1,14 g · mL–1 a partir de una disolución concentrada del 98 % y densidad 1,84 g · mL–1
- a) Determina la molaridad de la disolución concentrada.
- b) Calcula la cantidad, en volumen, de H2SO4 concentrado que hay que tomar para preparar 100 mL de la disolución diluida.
- c) Escribe como procedería en la preparación de la disolución diluida, citando el material de laboratorio que utilizaría.
DATOS: Ar(H) = 1 u; Ar(O) = 16 u; Ar(S) = 32 u.
Resultado: a) 18,4 M; b) 12,66 mL.
https://profesor10demates.com/2013/09/29/cursos-gratuitos-para-aprobar/
Os aconsejo que me sigáis en Facebook o en Twitter , y también en Youtube , así estaréis mejor informados de las novedades

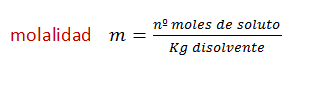
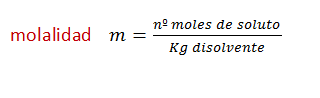
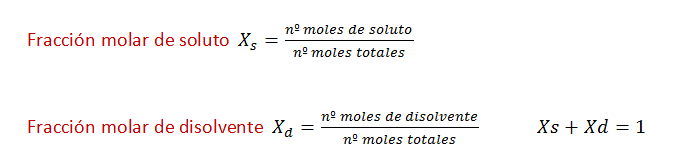







6 comentarios
Hola Sergio a ver si me puedes ayudar con este:
¿ Qué cantidad de ácido sulfúrico del 96 % (disolución) debe añadirse a 1 kg de ácido del 60 % para obtener un ácido del 90 %?
Se que da 5 kg pero no se como llegar a la respuesta. Saludos
participa en el concurso
http://profesor10demates.blogspot.com.es/2014/07/concurso-para-resolver-ejercicios-en.html
Hola Sergio, soy Miguel Angel. Hay un error en las soluciones del problema 20.
b) 1,23gramos KOH. El error viene de haber tomado como tercer aditivo 100cm3 de agua en vez de 10cm3. Corrígeme si me equivoco. Gracias.
Y esto para los que te visitan , por favor dar al me gusta que es lo menos que se puede hacer para agradecer el esfuerzo que hay detrás del trabajo de Sergio.
muchas gracias
cuando tenga tiempo lo reviso
saludos
hola profe muchas gacias por tus videos gracias a ti estoy aprobando mil gracias, PODRIAS HACER UN VIDEOS CON LAS SOLUCIONES DE LOS EJERCICIOS 20 Y 21 ME SERVIRIA DE GRAN AYUDA, YA QUE ESE TIPO DE EJERCICIOS ME VAN A ENTRAR PARA EL EXAMEN, MUCHAS GRACIAS SERGIO!! UURRGENTTEEE
Muchas gracias por tu trabajo Sergio, realmete fantástico, me está sirviendo mucho para repasar. Un saludo