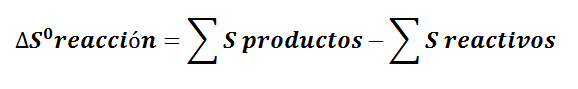Fórmulas y Ejercicios resueltos termodinámica entropía de una reacción química 1º 2º bachillerato acceso y universidad
Entropía (S)
La entropía es una función de estado, que mide el grado de desorden de un sistema.
El segundo principio de la termodinámica afirma que la entropía del universo, en un proceso espontáneo aumenta
Podemos calcular la entropía de dos formas .
1 De forma cuantitativa ( ojo la entropía esta tabulado en julios)

2 De forma cualitativa
TRUCO
Como ∆S tendrá el mismo signo que ∆n , entonces calculamos ∆n
Si ∆n>0 ⇒ ∆S>0 Aumenta el desorden de la reacción ( Sistema)
Si ∆n<0 ⇒ ∆S<0 Disminuye el desorden de la reacción ( Sistema)
Ejercicios de entropia resueltos
Ejercicios resueltos 01
Para el proceso N2O (g) + 3/2O2 (g) → 2 NO2 (g) a 298 K, calcula:
a) La entropía de reacción
DATOS: Sº (N2O) = 220,1 J/mol K; Sº(NO2) = 240,1 J/mol K; Sº (O2) = 205,2 J/mol K.
Ejercicios resueltos 02
Predice si en cada una de las siguientes reacciones hay variación positiva o negativa de la entropía:
a) 2 KClO4 (s) → 2 KClO3 (s) + O2 (g)
b) H2O (g) → H2O (l)
c) N2 (g) → 2N (g)
Ejercicios resueltos 03
Predice el signo de la entropía en las siguientes reacciones:
a) 2 NH3 (g) → N2 (g) + 3 H2 (g)
b) C3H8 (g) + 5 O2 (g) →3 CO2 (g) + 4 H2O (l)