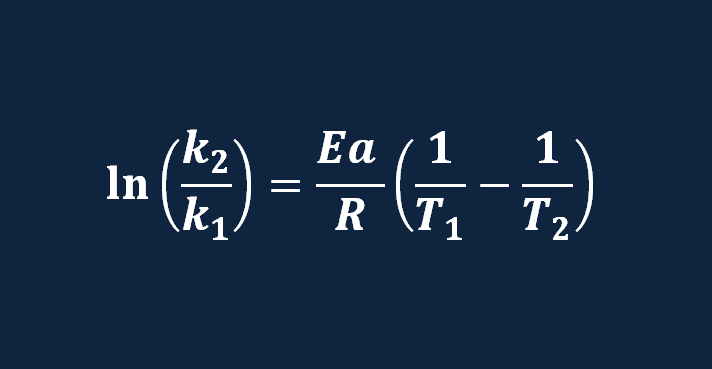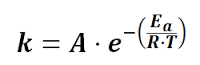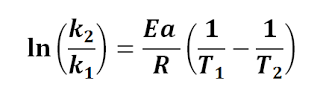ecuacion de arrhenius temperatura , efecto de la temperatura energía de activación , ejercicios resueltos , pdf cinética química , ejercicios resueltos pdf Química 2º Bachillerato universidad .
Demostraremos y haremos ejemplos de como aplicar la ecuación de Arrhenius , cuando trabajamos con temperaturas
IR AL INDICE DEL TEMA DE CINÉTICA QUÍMICA
IR AL INDICE DEL TEMA DE CINÉTICA QUÍMICA