redox pilas y electrolisis ejercicios resueltos paso a paso , química 2 bachillerato y universidad Selectividad EBAU EVAU , problemas resueltos de reacción Redox medio ácido , redox medio básico , por el método ión electrón , pilas galvánicas y electrolesis con la segunda ley de Faraday
Tema reacciones de transferencia de electrones
Pilas galvánicas ejercicios resueltos
Electrólisis Ejercicios resueltos Ley de Faraday
redox pilas y electrolisis
Si los videos te han servido , dale al 🔥 LIKE y SUSCRíBETE y activa la campanilla 🔔, en época de exámenes subimos muchos ejercicios clásicos de exámenes y así estarás informado ➡ compártelo por las redes sociales y grupos de clase 😉
Redox medio ácido
Pasos para las semireacciones en medio ácido
1 Ajustamos el elemento
2 Ajustamos los oxígenos con H2O
3 Ajustamos los H con H+
4 Ajustamos la carga con e–
Ejercicio resuelto 01
Dada la reacción: MnO2 + HCl → MnCl2 + H2O + Cl2
Ajuste las reacciones iónica y molecular por el método del ión-electrón. Ver solución
Ejercicio resuelto 02
Dada la siguiente reacción: HCl+ KMnO4 → Cl2 + KCL + MnCl2 +H2O
Ajuste las reacciones iónica y molecular por el método del ión-electrón. Ver solución
Calcular el número de oxidación | Súper resumen
Realizaremos el Súper resumen que siempre hago con mis alumnos donde calcularemos los números de oxidación de los compuestos más clásicos de examen con CLAVES y TRUCOS
Ejercicio resuelto Calcula los números de oxidación de:
AgNO3 KMnO4 K2Cr2O7 CaCO3 FeSO4 Cu(NO2)2
Ca(ClO4)2 Cr(NO3)3 Fe3(PO4)2 Al2(CrO4)3 K2MnO4 CuSO3
Ejercicio resuelto EBAU
El estaño metálico es oxidado por el ácido nítrico a óxido de estaño (IV) obteniéndose además óxido de nitrógeno (IV) y agua. a) Escriba y ajuste las semirreacciones de oxidación y reducción que tienen lugar. b) Escriba la reacción iónica y la molecular global ajustadas por el método del ion electrón. c) Calcule la masa obtenida de óxido de estaño (IV) si se hace reaccionar 100 g de estaño de riqueza 70% en masa, sabiendo que el rendimiento de la reacción es del 90%. Datos: R = 0,082 atm·L·mol–1 ·K–1 ; Masas atómicas: O = 16,0; Sn = 118,7 ver solución
Ejercicios resueltos 03
El agua oxigenada (H2O2) reacciona con una disolución acuosa de permanganato de potasio, (KMnO4), acidificada con ácido sulfúrico, (H2SO4), para dar oxígeno molecular, sulfato de potasio, (K2SO4), sulfato de manganeso (II), (MnSO4) y agua.
a) Ajusta la reacción molecular por el método del ión-electrón. Ver solución
REDOX MEDIO BÁSICO
Pasos para las semireacciones en medio Básico
1 Ajustamos el elemento
2 Ajustamos los oxígenos con OH–
(Truco poner el doble de OH– )
3 Ajustamos los H con H2O
4 Ajustamos la carga con e–
Redox medio Básico ejercicios resueltos paso a paso
Ejercicios 01
Dada la siguiente reacción: KMnO4 + KI + KOH →K2MnO4 + KIO3+ H2O
Ajusta las semireacciones de oxidación y reducción por el método del ión-electrón y ajusta tanto la reacción iónica como la molecular. Ver solución
Ejercicios resueltos 02
El yodo, I2, reacciona en medio básico, NaOH, con el sulfito sódico, Na2SO3, para dar yoduro sódico, NaI, y sulfato sódico, Na2SO4.
a) Ajusta la reacción molecular por el método del ión-electrón.
Ejercicios resueltos 03
El nitrato de potasio (KNO3) reacciona con el dióxido de manganeso (MnO2) e hidróxido de potasio (KOH) para producir nitrito de potasio (KNO2), permanganato de potasio y agua.
a) Ajusta la reacción en medio básico por el método del ión electrón. Ver solución
Dismutación
Reacción de dismutación cuando una misma sustancia se oxida y se reduce
Ejemplo resuelto
Ajusta la siguiente reacción por el método ión-electrón en medio ácido
MnSO4 + KMnO4 → MnO2 + K2SO4 + H2SO4
PROBLEMAS DE ESTEQUIOMETRÍA CON LAS REACCCIONES AJUSTADAS POR EL MÉTODO ION ELECTRÓN
Es muy típico de examen los ejercicios de estequiometría que tienen que ser ajustados por REDOX . Si tienes oxidadas las reacciones químicas te dejo un SÚPER RESUMEN FORMULARIO DE REACCIONES QUÍMICAS EN VÍDEO
Ejercicio resuelto de selectividad CLÁSICO DE EXAMEN 1
El hierro reacciona con el ácido sulfúrico según la reacción:
Fe + H2SO4 → Fe2(SO4)3 + SO2 +H2O
a) Ajuste las ecuaciones iónica y molecular por el método del ion-electrón.
b) Si una muestra de 1,25 g de hierro impuro ha consumido 85 mL de disolución 0,5 M de H2SO4, calcule su riqueza en hierro.
Dato: Masa atómica relativa: Fe= 55,8
Ejercicio resuelto Selectividad
Una disolución de dicromato de potasio en medio ácido sulfúrico, reacciona con plata y se forma sulfato de cromo (III), sulfato de plata y sulfato de potasio. a) (0,5 puntos) Formule y ajuste las semirreacciones de oxidación y reducción que tienen lugar. b) (0,75 puntos) Ajuste las reacciones iónica y molecular globales por el método del ion-electrón. c) (0,75 puntos) Calcule el volumen de disolución de ácido sulfúrico de concentración 1,47 g·L–1 que se necesita para oxidar 2,16 g de plata. Datos. Masas atómicas (u): H = 1,0; O = 16,0; S = 32,1; Ag = 107,9
Ejercicio resuelto Método Ión electrón clásico de examen 2
El dicromato de potasio en presencia de ácido clorhídrico reacciona con el cloruro de estaño(II), obteniéndose cloruro de estaño(IV) y cloruro de cromo(III).
a) (1 punto) Formule y ajuste las semirreacciones de oxidación y reducción utilizando el método del ion electrón, indicando cuál es el cátodo y el ánodo y las especies oxidante y reductora. Escriba la reacción completa iónica y molecular.
b) (1 punto) Determine la riqueza en % masa de la disolución de HCl comercial de densidad 1,18 g·ml-1 que se ha utilizado para preparar el ácido clorhídrico empleado en la reacción sabiendo que 25 ml de la disolución de ácido clorhídrico reaccionan con 12 g de cloruro de estaño(II).
Datos: Masas atómicas (u): H = 1,0; Cl = 35,5; Sn = 118,7.
PILAS GALVÁNICAS EJERCICIOS RESUELTOS
ejercicios resueltos pilas galvánicas redox
Indica las semirreacciones que tienen lugar en el ánodo y en el cátodo , la reacción global de la pila y la fuerza electromotriz de las pilas galvánicas construidas con los siguientes electrodos :
a) E0( Zn2+/Zn) = -0,76 V ; E0(Ag+/Ag) = 0,80 V. ver solución
b) E0(Ag+/Ag) = 0,8 V; E0(Cd2+/Cd) = – 0,40 V; ver solución
EBAU Ejercicio resuelto selectividad
Se forma una pila galvánica con un electrodo de hierro y otro de plata. Teniendo en cuenta los potenciales de reducción estándar que se adjuntan: a) Escriba las semirreacciones que tienen lugar en el ánodo y en el cátodo de la pila galvánica e indique el sentido del movimiento de los iones metálicos de las disoluciones con respecto a los electrodos metálicos. b) Calcule el potencial de la pila formada. c) Dibuje un esquema de la pila indicando sus componentes. d) Razone qué ocurriría si introdujéramos una cuchara de plata en una disolución de Fe2+ Datos. E0 (V): Ag+ /Ag = 0,80; Fe2+/Fe = − 0,44.
PILAS GALVÁNICAS Ejercicio resuelto clásico de examen
A partir de los valores de potenciales normales de reducción, responda razonadamente a las siguientes cuestiones:
a) (0,75 puntos) Determine el potencial de una pila galvánica formada por un electrodo de platino sumergido en una disolución de permanganato de potasio en medio ácido sulfúrico y un electrodo de plomo sumergido en una disolución de nitrato de plomo(II). Ajuste las semirreacciones de oxidación y reducción, indicando el ánodo y el cátodo.
b) (0,5 puntos) Ordene las especies MnO4– , Pb2+ , Cu+ y Fe2+ de menor a mayor poder oxidante.
c) (0,75 puntos) Explique el proceso que tiene lugar si una pieza de hierro metálico se introduce en una disolución de cobre(I). Razone su espontaneidad.
Datos : E0(V): Fe2+/Fe= -0,44 ; Pb2+/Pb= -0,13 ; Cu+/Cu=0,52 ; MnO4–/Mn2+ = 1,52
ELECTRÓLISIS LEY DE FARADY
Electrólisis
Proceso en el que se utiliza el paso de una corriente eléctrica por una disolución o electrolito fundido para producir una reacción Redox No espontánea.
El recipiente donde se realiza la electrólisis se llama cuba o celda electrolítica
Igual que en una pila galvánica en el electrodo donde se produce la reducción se llama cátodo y el electrodo donde se produce la oxidación ánodo , pero ahora el cátodo es negativo y el ánodo positivo
Ejemplos de Aplicación de la Electrólisis
Recarga de pilas y baterías
Producción de metales ( Aluminio , sodio , …)
Producción de productos químicos ( cloro NaOH ,flúor , …)
Recubrimientos o bañados metálicos ( bañado en oro , plata cobre , como las monedas de céntimos de euro)
Producción de hidrógeno (vector energético , forma de almacenamiento de energía , si el hidrógeno es producido por energías renovables , se denomina hidrógeno verde )
Electrólisis del agua
La electrólisis del agua es una apratado muy importante en este tema ya que cae mucho en forma teórica y tambien como aplicación práctica en problemas , por lo tanto es un clásico de examen
La reacción de descomposición del agua no es espontánea , para que se produzca es necesaria un aporte de energía , que será suministrada mediante una corriente eléctrica ( electrólisis) , como el agua pura no conduce la electricidad , es necesario realizar una disolución acuosa , generalmente se utiliza ácido sulfúrico o hidróxido de sodio .
Se producen las siguientes reacciones :
Ánodo | oxidación (+): 2H2O(l) →O2(g) + 4 H+(aq) +4 e-
Cátodo |reducción (-): 2H+ (aq) +2e- → H2(g)
Reacción global : 2H2O(l) → O2(g)+ 2H2(g)
Segunda ley de Faraday
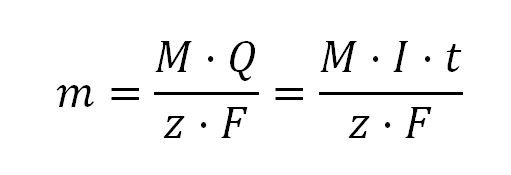
Siendo:
m la masa en gramos
M La masa atómica
Q la carga en culombios (C)
I la intensidad de corriente en amperios (A)
t el tiempo en segundos
F la constante de Faraday
z Número de electrones intercambiados en la semireacción
Es interesante tener en cuenta que igual que en las pilas galvánicas, la reducción se produce en el cátodo y la oxidación en el ánodo, sin embargo, en la electrólisis el cátodo es negativo y el ánodo es positivo , mientras en la pila galvánica es al revés
Ejercicios resueltos de electrólisis
Si los videos te han servido , dale al 🔥 LIKE y SUSCRíBETE y activa la campanilla 🔔, en época de exámenes subimos muchos ejercicios clásicos de exámenes y así estarás informado ➡ compártelo por las redes sociales y grupos de clase 😉
Ejercicio Resuelto 01
En una celda electrolítica conteniendo CuCl2 fundido se hace pasar una cierta cantidad de corriente durante 2 horas, observándose que se deposita cobre metálico y se desprende cloro.
a) Disocie la sal y escriba ajustadas las reacciones que se producen en el ánodo y en el cátodo.
b) Determine la intensidad de corriente necesaria para depositar 15,9 g de cobre.
c) Calcule el volumen de cloro obtenido a 25 ºC y 1 atm. Datos. Masa atómica: Cu = 63,5. F = 96485 C. R = 0,082 atm·L·mol−1·K−1
Ejercicio Resuelto 02
Se lleva a cabo la electrólisis de una disolución acuosa de cobre (II)
a) Escriba las reacciones que se producen en el cátodo y en el ánodo y calcule la carga necesaria para depositar 7,5 g de cobre
b) Si se utiliza la misma carga del apartado anterior para llevar a cabo la electrólisis del agua ¿ qué volumen de hidrógeno se desprende a 33º C y 726 mmHg ?
Datos. Masa atómica: Cu = 63,5. F = 96485 C. R = 0,082 atm·L·mol−1·K−1
OTROS ENLACES QUE TE PUEDEN INTERESAR
Química 2º Bachiller ejercicios y problemas resueltos
Experimentos reacciones químicas
Ion Común solubilidad ejercicios resueltos
QUIMICA 2 º BACHILLERATO EXAMEN FINAL
EXAMENES PROBABILIDAD DISTRIBUCION NORMAL Y BINOMIAL
CURSO DE MATEMÁTICAS 1º BACHILLERATO
CURSO DE MATEMÁTICAS SOCIALES 1º BACHILLERATO
CURSO DE FÍSICA Y QUÍMICA 1º BACHILLERATO
CURSO MATEMÁTICAS 2 BACHILLERATO